Tüm elementler son katmanlarını tam olarak doldurmak ister. Doğada bulunan elementlerin sadece 6 tanesinin son katmanı tamamen doludur. Diğer elementler son katmanlarını doldurmak için elektron alışverişi yaparlar.
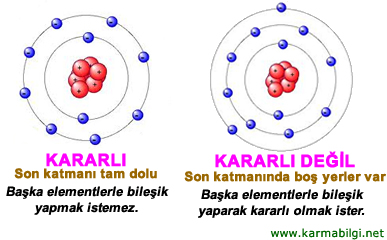
Kararlı Element Nedir?
Bir elementin son katmanı tamamen doluysa bu element KARARLIdır.
Bir elementin kararlı olması başka elementlerle bileşik yapmak istememesi, ‘kendi haline olması’ anlamına gelir.
Yani kararlı atomlar elektrona ihtiyaç duymadıkları için kendi kendilerine yeterler.
Soygaz ya da asal gaz olarak bilinen 6 elementin son katmanları tam olarak doludur. Bu elementler doğal olarak kararlıdır.
Kararlı Olmayan Atomlar
Bu atomların son katmanları tam dolu değildir.
Tüm atomlar tıpkı soygazlarda olduğu gibi son katmanlarını doldurmak ister. (Soygazlara benzemek ister)
Örneğin Sodyum elementinin 11 elektronu vardır. Bu elementin son katmanında 1 elektron bulunur.
O halde Sodyum kararlı değildir.
Bu 1 elektronunu başka bir atoma vererek fazlalıktan kurtulur ve sodyuma tam dolu olan 3. katmanı kalır.
Bu sayede Sodyum KARARLI hale gelir.
İlk 20 elementin kararlı iyon yükleri
Elementler kararlı hale geçerken elektron alır veya elektron verir demiştik.
Bir atom elektron almamış veya vermemişse iyon yükü yoktur.(nötr atom)
Ama elektron alışverişi yaptığında artı ve eksi yüklerle yüklenirler.
Eğer elektron alınıyorsa atom eksi yüklü,
Eğer elektron veriliyorsa atom artı yüklüdür.
Aşağıda ilk 20 elementin kararlı hale geçmek için kaç elektron alacakları veya kaç elektron verecekleri ve sonrasında iyon değerleri gösterilmiştir.
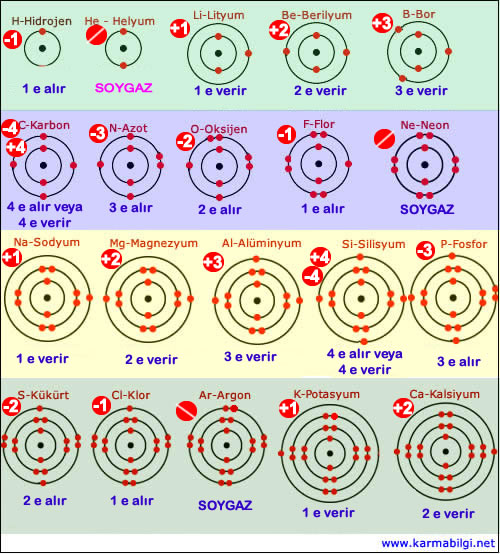
Yukarıdaki şekli incelediğimizde elektron sayısı 20 olan Kalsiyumun son katmanında 2 e bulunur. Kalsiyum ya 6 elektron daha alarak 4. katmanını tam dolu yapacak, ya da 2 elektronunu vererek geriye tam dolu 3. katmanı kalmasını sağlayacaktır.
Kolay olan 6 elektron almaktansa 2 elektron vermek olduğu için kalsiyum 2e verir ve kararlı hale geçer.
Eksi yüklü 2 elektronun gitmesi kasiyumu +2 yüklü hale getirir.
17 elektronlu Klor atomuna baktığımızda son katmanında 7 elektron vardır. Klor kararlı hale geçmek için ya 1 elektron alacak, ya da 7 elektronunu verecektir.
1 elektron almak daha kolay olduğu için klor başka bir atomdan 1 elektron alır ve kararlı hale geçer.
Eksi yüklü 1 elektronun gelmesi Kloru -1 yüklü hale getirir.
Soygazlar kararlı olduğu için + veya – yük almazlar. Elektron alışverişi yapmazlar.
Elementlerin iyon yükleri sembollerinin üst bölgelerine sayı ve işaretleriyle beraber yazılır.
Örneğin;
+2 yüklü kalsiyum iyonunun gösterilişi: ………………….. Ca2+
-3 yüklü azot iyonunun gösterilişi: ………………….. N3-
+1 yüklü sodyum iyonunun gösterilişi: ………………….. Na+
-1 yüklü klor iyonunun gösterilişi: ………………….. Cl–

Hani magnezyum iki elektoron verip kararlı hale geliyor ya . Peki bu ;
12^Mg ^ + 2 diye mi ?
10 ^ Mg ^ + 3 diyemi gösterilir ?
Mg 2+ olarak gösterilir